背景
据南方医药经济研究所数据,2021年我国医疗器械产业收入(规上+规下)已经超过1.1万亿;国际管理咨询公司罗兰贝格的数据也显示2022年医疗器械市场规模约为9600亿。不同口径的数据稍有出入,但是中国医疗器械市场已经成为全球最重要的市场,这已毫无疑问。
近20年,医疗器械行业得到了飞速发展。但客观来看,与欧美日主要发达体相比,国内仍然小、散、研发能力不足。在野蛮时代可以迅速做大,但不光做大还要做强,这已成为中国医疗器械行业未来的重要命题。
政策层面,党中央与国务院非常重视医药改革。伴随2014年开始国药监局正式推动创新医疗器械的审批审批,极大地促进了产业的创新发展。而这几年来医保相关政策又不断把创新的讨论推向舞台中央。
创新医疗器械的条件
在中国,创新医疗器械从三个方面去界定:专利、产品定型、原理首创技术先进临床显著价值。
虽然看起来是三个要素,仔细理解就会发现,真正的牵引力量是显著的临床价值。在充分理解现有临床诊疗现状(技术、产品)的基础上,才能洞察到临床未被满足的需求,从而运用企业的技术攻关能力,在医疗器械研开发体系的框架下,做出相关创新产品。
与美国相比,国内企业对于需求洞察与满足的能力缺乏,可能更比技术能力的不足阻碍着发展。很多企业仍把器械药物化,希望通过基础科研就能解决产品创新问题。基础科研的发展当然是一切创新的源泉和底层支撑,但在医疗器械产业界,恐怕要把临床/外科需求摆在牵引的位置上,再去匹配技术攻关,才能做出真正被需要的产品。
我们需要一些代表性的样本,去找到一些规律和趋势,提升真正的需求洞察与产品满足能力。而创新医疗器械这个样本无疑是非常有代表性的研究对象。
已获批的创新医疗器械信息
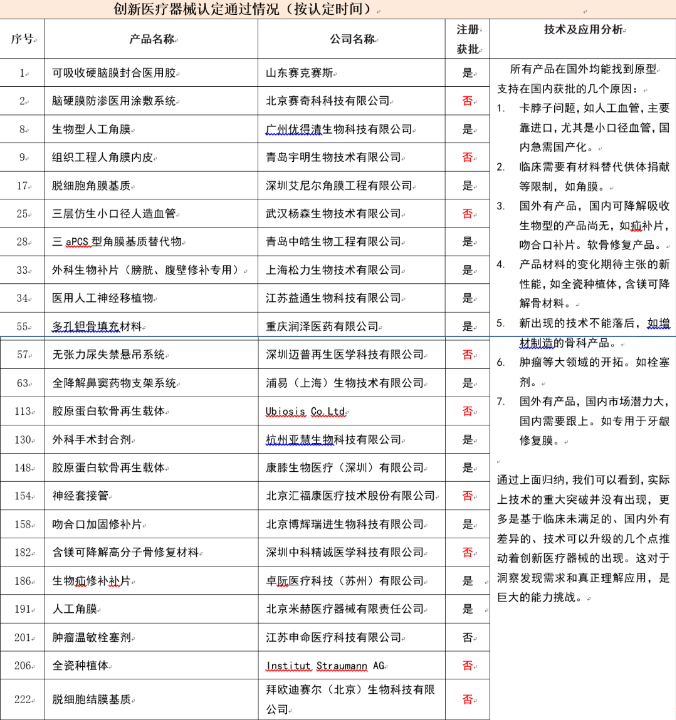
从2014年至2022年底,共有将近2100项创新医疗器械的申报申请,其中共有420余项通过了创新审批并公示通过,通过率大概是20%。
在420余项通过创新审批的产品中,共有189项完成了注册审批通过,获得了医疗器械注册证。
是否所有创新产品都会上市
创新审查结果告知后5年内,未申报注册的创新医疗器械,不再按照本程序实施审查。
5年后,申请人可按照本程序重新申请创新医疗器械特别审查。
我们分析了2017年(含)前所有创新认定的产品:共有155款获得创新认定通过,已经获得注册获批的有98款,仍有57款并未完成注册获批工作。可能的原因:1.由于各种原因,企业放弃了产品的继续开发;2.开发进度缓慢,仍在开发中。但是,重新申请创新审查的企业很少,因此我们判断这50多款产品可能大部分无法成为最终的市售产品了。
创新认定后多久可获批上市
对2017年前所有通过创新认定且到目前已经获批上市的产品进行分析,创新认定后到
上市获批时间从0年-5年均有分布,没有特别规律,主要与产品开发难度(如长周期临床试验)及创新申报的时机(中试定型后还是临床阶段)有关。
无源植入材料产品